Alken ya da olefin, organik kimyada en az bir adet karbon-karbon çift bağı içeren doymamış hidrokarbon. Sadece bir çift bağ içeren ve başka bir fonksiyonel grubun bağlanmadığı en basit alkenler CnH2n formülüne sadık kalarak homolog bir sıra oluştururlar.
En basit alken olan etilen(C2H4) IUPAC adlandırma kurallarına uygun olarak ‘’eten’’ olarak da isimlendirilir. Alkenler, petrokimyada yaygın olarak ‘’olefinler’’ ya da ‘’vinil bileşikleri’’ olarak da bilinir.,
Yapıları
VSEPR teorisiyle varsayıldığı üzere alkenlerde çift bağ yapan karbon atomlarının arasında yaklaşık 120° açı oluşmaktadır. Bu açı Van der Waals etkileşimleri ve bağa katılmayan fonksiyonel grupların etkileri ile değişebilir. Örnek olarak propen molekülünde bağ açısı 123.9° dir. Alken çift bağı tekli kovalent bağdan daha güçlüdür ve 133 pikometre daha kısadır.
Moleküler geometri
Tekli kovalent bağlarda olduğu gibi çift bağlar da üstüste gelen atomik orbitaller olarak tanımlanabilir. Ancak tekli kovalent bağ sadece bir adet sigma bağından oluşurken, çift kovalent bağ bir sigma bir pi bağından meydana gelmiştir.
Çift bağa dahil olan her karbon kendi üç sp2 hibrit orbitalini, üç atomla sigma bağı yapmak için kullanır. Hibritleşmemiş ve diğer üçünün oluşturduğu düzleme göre dik açıda kalan ‘’2p’’ orbitalleri etkileşerek pi bağını oluştururlar.
Pi bağını kırmak için büyük miktarlarda enerji gerektiğinden (etilende 264 joule/mol) karbon-karbon çift bağını döndürmek oldukça zordur ve büyük oranda kısıtlanmıştır. Bunun sonucu olarak sübsitüyent bağlı alkenlerde ‘’cis’’ ve ‘’trans’’ olmak üzere iki geometri izomeri türü oluşabilir. Örnek olarak ‘’cis’’-2-büten molekülünde metil sübsitüyentler aynı tarafa bakarken ‘’trans’’-2-büten molekülünde metil sübsitüyentler ters tarafa bakarlar.
Biri çift bağı çevirmek zor olsa da imkânsız değildir. Gerçekte, 90°lik bir çevirme işlemi pi bağının gücünün yarısına eşittir. P orbitallerinin yanlış yerleşimi beklenenden azdır çünkü piramidal yapı oluşmaya başlar. (Bkz: Piramidal alken)
trans-Siklooktan kararlı gerginlikte bir alkendir ve orbital dizilimi 137°lik (normal 120°) iki düzlemli açıyla 19° olacak şekildedir ve 18°lik piramitsel yapıya sahiptir. Bu, sıfır olması beklenen bu bileşiğin (cis-izomer 0.4 D) dipol momentinin 0.8 D olduğunu göstermektedir.[1] Sikloheptan'ın trans izomeri yalnızca düşük sıcaklıkta kararlıdır.
Fiziksel Özellikler
Alkenlerin fiziksel özellikleri alkanlar ile karşılaştırılabilir. Fiziksel durum molekül ağırlığına (etenden bütene kadar gaz, pentenden sonra sıvı) bağlıdır. En basit alkenlerden olan eten, propen ve büten gazdır. 5-16 arası karbona sahip olan düz zincirli alkenler oda sıcaklığında sıvıdır, daha fazla karbon sayısına sahip olanlar katıdır.
Kimyasal Özellikler
Alkenler oldukça kararlı bileşiklerdir fakat karbon-karbon çift bağ(lar)ından dolayıalkanlara göre daha etkindir. Alkanlardaki tekli karbon-karbon bağlarından daha güçlü olmasına rağmen, alkenlerin aktifliğinin ana sebebi bu çift bağın koparak iki yeni tekli bağ oluşturmalarıdır.
Alkenler petrokimya endüstrisinde katkı malzemesi olarak kullanılmaktadır çünkü birçok reaksiyona katılabilme özelliğine sahiptirler.
Katılma tepkimeleri
Alkenler çift bağın açıldığı birçok katılma tepkimesine girer.
- Hidrojenin katalitik katılması: Bu katılma tepkimesisöz konusu alkeni alkan türüne çevirir. Tepkime metal bir katalizör varlığında ve basınç altında yapılır. Yaygın katalizörlerde kullanılan metaller platinyum, nikel ve paladyumdur. Labratuvar sentezinde Raney nikeli kullanılır. Bu katalizör bir nikel-alüminyum alaşımıdır. Bu tepkime için tipik bir örnek, etilenin katallitik hidrojenleme yöntemiyle etana çevrilmesidir:
- CH2=CH2 + H2 → CH3-CH3
- Elektrofilik katılma: Alkenlerin çoğu katılma reaksiyonları elektrofilik katılma mekanizmasını izler. Elektrofilin bir karbonil grubu olduğu Prins reaksiyonu buna bir örnektir.
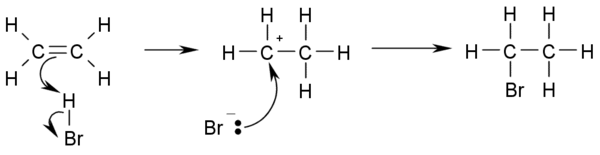
- Halojenleme: Elementar haldeki brom ve klorun alkenlere katılmasıyla sırasıyla benzer dibrom ve dikloroalkenler ortaya çıkar. Bir brom solüsyonunun suda renk değiştirmesi alken varlığının analitik testidir.
- CH2=CH2 + Br2 → BrCH2-CH2Br
- Ayrıca, tekli bir bileşik veya karışımın brom numarasını göstererek doygunsuzluk testi uygulamakta mümkündür. Reaksiyon gerçekleşir çünkü çift bağlardaki yüksek elektron yoğunluğu kalıcı bir uyarılmış dipolün yol açtığı Br-Br bağında elektronların kalıcı yer değişmeleri oluşur. Bu olay, Br'nin en yakın pozitif çift bağa ulaşmasını sağlar ve elektrofil gerçekleşir.
- CH3-CH=CH2 + HBr → CH3-CHBr-CH2-H
- Eğer çift bağda bulunan iki karbon atomu farklı sayıdaki hidrojen atomları ile bağ yaparsa, halojen az karbonlu bir yapıyı tercih eder. (Markovnikov kuralı).
- Bu olay hidrohalojenleşmenin reaksiyon mekanizmasıdır.
Oksidasyon
Alkenler büyük sayıdaki yükseltgenler ile oksitlenebilirler.
- R1-CH=CH-R2 + O3 → R1-CHO + R2-CHO + H2O
- Bu reaksiyon bilinmeyen bir alkenin çift bağlarının pozisyonlarını belirlemede kullanılabilir.
Polimerizasyon
Alkenlerin polimerizasyonu polietilen ve polipropilen plastikleri gibi yüksek endüstri değerli polimerleri açığa çıkaran ekonomik olarak önemli bir reaksiyondur. Polimerizasyon hem köksüz hem de iyonik olarak devam edebilen bir mekanizmadır.
Sentez
- CH3CH2OH + H2SO4 (conc. aq) → CH3CH2OSO3H + H2O → H2C=CH2 + H2SO4 + H2O
- Diğer alkol eliminasyonları Chugaev eliminasyonu ve ilk olarak alkol grubunun kısa ömürlü bir ara ürüne dönüştüğü Grieco eliminasyonudur.
Simetrik olmayan ürünlerde yerine koyma reaksiyonu geçiren karbonlar (az hidrojenli) çift bağlarda daha sabit bir bölgeye yerleşme eğilimindedirler. (Bkz. Saytzeff kuralı).
Sistematik İsimlendirme
Alkenlerin IUPAC isimlendirmeleri yapılırken, basit olarak temel bileşikteki -an- orta eki -en- olarak değiştirilir. Örneğin, CH3-CH3 etAN alkanıdır. CH2=CH2 bileşiği ise etENdir.
İleri alkenlerde, çift bağın konumunun farklılık gösterdiği izomerlerin olduğu yerlerde, şu numaralandırma sistemi kullanılır:
- Çift bağ içeren en uzun karbon zincirini, çift bağlı karbon atomları yönünde en küçük pozitif sayılarla numaralandır.
- Çift bağın konumunu ilk karbonun bulunduğu yerle göster.
- Dallı veya yedek alkenleri, tıpkı alkanlarda olduğu gibi isimlendir.
- Karbon atomlarını numaralandır, yedek grupları belirle ve isimlendir, çift bağların yerlerini belirle ve asıl zinciri isimlendir.

Naming substituted hex-1-enes
E,Z Yazımı
Bir alkenin birden fazla yedek atomu bulunduğu zaman çift bağın geometrisi E ve Z etiketleri kullanılarak gösterilir. Bu etiketler, "karşıt" manasındaki "entgegen" ve "birlikte" manasındaki "zusammen" Almanca kelimelerinden gelmektedir. Çift bağlı atomların aynı taraftaki yüksek öncelikli grupları birlikte diye tanımlanır ve Z ile gösterilir. Karşı taraftaki yüksek öncelikli gruplar ise E ile gösterilmektedir.