Karboksilik asitler karboksil grubu olan organik asitlerdir, -C(=O)OH formülüne sahiptirler, bu genelde -COOH veya CO2H olarak da yazılır.[1] Karboksilik asitler Bronsted asitleridir, yani proton vericileridir. Karboksilik asitlerin tuz ve anyonlarına karboksilat denir.
Karboksilik asitlerin en basit dizisi alkanoik asitlerdir, R-COOH formülüyle gösterilirler, R bir hidrojen atomu veya bir alkil grubuna karşılık gelir. Bileşiklerde birden fazla karboksilik asit grubu bulunabilir.
Yapısı

Karboksil grubunun üç boyutlu yapısı

Karboksil grubunun hacim dolduran modeli
Fiziksel özellikler
Karboksilik asitler polar moleküllerdir ve birbirleriyle hidrojen bağları kurarlar. Yüksek sıcaklıkta, buhar fazında, karboksilik asit molekülleri çiftler (dimer) halinde bulunurlar. Kısa karboksilik asitler (1-4 karbonlu) suda çözürler, daha uzun olanları ise alkil zincirin gittikçe artan hidrofobik özelliği yüzünden çok daha az çözünürler. Eter ve alkol türü daha az polar çözücülerde çözünme eğilimleri vardır.[2]
Karboksilik asitler tipik olarak zayıf asitlerdir, yani sadece kısmen H+ katyonu ve RCOO− anyonlarına ayrışırlar. Örneğin, oda sıcaklığında suda çözünmüş asetik asit molekülerinin yalnızca % 0.02 ayrışmış durumdadır.
Karboksilik asitler zayıf asitler olduklarından suda her iki biçimleri arasında bir denge oluşur:
- RCOOH ↔ RCOO- + H+
Karboksilik asitlerin asitlikleri hem asit halin, hem de eşlenik (konjüge) bazın kararlılığı ile açıklanabilir.
Asidin kararlılığı
Karboksilik asitlerin asitliği, iki elektronegatif oksijen atomunun O-H bağını çevreleyen elektron bulutunun şeklini bozarak bu bağı zayıflatması ile, endüktif etkiler ile açıklanabilir. Zayıf O-H bağı asit molekülünün daha az kararlı olmasına neden olur ve hidrojen atomunun daha kolay ayrışıp H+ iyonu salmasına neden olur. Asit karasız olduğu için denge sağa kaymış durumdadır.
Ek elektronegatif atom veya grupların, R grubu üzerinde bulunana klor veya hidroksil gibi, benzer ama daha zayıf etkileri olur. Bu grupların varlığı endüktif etki sonucu asitliği artırır. Örneğin (üç -Cl grubu olan) trikloroasetik asit, laktik asitten (bir -OH grubu olan)daha kuvvetli bir asittir, o da asetik asitten (hiç elektronegatif parçası olmayan) daha kuvvetlidir.
Birleşik bazın kararlılığı

Karboksilik asitlerin resonansla kararlı hale gelmeleri
Karboksilik asitin kararlılığının bir diğer açıklaması rezonans etkileri iledir. Karboksilik asitin ayrışmasının sonucu ortaya çıkan ürün rezonansla stabilize olmuştur, negatif yük iki oksijen atomu arasında paylasılmış (yersizleşmiş, delokalize olmuş) durumdadır. Her bir karbon-oksijen bağının kısmî bir çift bağ özelliği vardır. Eşlenik baz bu şekilde stabilize olduğu için denge sağa kaymış durumdadır. Benzoik asidin konjüge bazındaki negatif yük hem iki oksijen atomu hem de benzen halkası üzerinde yersizleşmiş durumdadır. Bu yüzden benzoik asit asttik asitten daha asittir.
Spektroskopi
Karboksilik asitler kızıl ötesi spektroskopisi ile kolaylıkla tanınabilirler. 1680 ile 1725 cm-1 arasında keskin bir C=O gerilmesi vardır, ayrıca karboksil grubununun kendine has O-H gerilmesi 2500 ile 3000 cm-1 arasında yayvan bir tepe olak belirir.[2]
1H NMR spektrometresinde hidroksil hidrojeni 10-13 ppm bölgesinde görünür, ama eser miktarda su ile değişim yüzünden ya genişlemiş olur ya da hiç gözlemlenmez.
Tepkimeler
Karboksilik asitler bazlar ile tepkiyip karboksilat tuzları oluştururlar, hidroksildeki hidrojen bir metal katyonu ile yer değiştirir. Böylece, örneğin sirkede bulunan asetik asit, sodyum bikarbonat ile reaksiyona girip sodyum asetat, karbon diyoksit ve su oluşturur:
- CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O
Karboksilik asitler alkol ve aminlerle tepkiyip ester ve amidler oluştururlar. Diğer alkol ve fenoller gibi karboksilik asitlerdeki hidroksil de, tionil klorür kullanılarak klor atomuyla yer değiştirip asil klorürler oluşturabilir.
Karboksilik asitler lityum aluminyum hidrit veya boran ile indirgenip birincil alkoller oluşturabilirler ancak bu tepkimelerden birincisi yavaştır. Esterler daha kolay indirgenebilirler, bu yüzden asitlerin indirgenmeden evvel esterleştirilmesi genelde daha mümkündür.
Tüm karbonil bileşikler gibi α-karbondaki protonlar da keto-enol totomerizasyonu ile ayrılmaya müsaittir. Böylece, Hell-Volhard-Zelinsky halojenasyonu ile alfa karbon kolayca halojenleşebilir.
Adlandırma ve örnekler
Karboksilat anyonu R-COO- genelde -at eki ile adlandırılır, dolayısıyla, örneğin, asetik asitinin iyonuna asetat denir. IUPAC adlandırma sisteminde karboksilik asitlerin -oik asit eki olur (örneğin oktadekanoik asit). Genel kullanımda ek genelde -ik asit şeklindedir (örneğin stearik asit).
Bazı karboksilik asit sınıflarının temsilcileri aşağıda listelenmiştir:
Ester
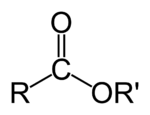
Bir karboksialt esterin genel formülü.
Kimyada esterler, bir hidroksil grubundaki hidrojen atomunun bir organik grup (bu metinde R' olarak gösterilecektir) ile yer değiştirmiş olduğu organik bileşiklerdir. Hidrojenin bir H+ iyonu olarak ayrışabileceği -OH grubu olan bu tür asitlere oksijen asidi denir
En yaygın esterler karboksilat esterlerdir, bunlarda söz konusu asit bir karboksilik asittir. Örneğin, eğer asit asetik asit ise, esterine asetat denir. Kararsız bileşikler olan karbamik asit veya karbonik asitten, sırasıyla, karbamatlar,RO(CO)NHR', ve dialkil karbonatlar,RO(CO)OR, gibi kararlı esterler elde edilebilir. Esterler inorganik asitlerden de oluşabilirler, örneğin dimetil sulfat bir esterdir ve bazen "sülfürik asit dimetil ester" olarak adlandırılır.
Esterler tuzlara benzer, benzer şekilde adlandırılırlar; katyon ve anyonları olmasa da, kullanılan terminoloji aynı biçimdedir: daha elektronegatif olan kısmın ardından daha elektropozitif olan kısım söylenir.
Esterler bir asit (genelde bir organik asit) ile bir alkolun (veya fenol bileşiğinin) yoğunlaşma tepkimesi ürünü olarak düşünülebilir, ama esterleri elde etmek için başka tepkimeler de vardır. Yoğunlaşma (kondansasyon) iki molekülün birleşerek küçük bir molekülü attıkları bir tip kimyasal tepkimedir; bu durumda iki -OH grubu birleşirken bir su molekülü atılır. Ester oluşumuna yol açan yoğunlaşma tepkimesine esterleşme denir. Esterleşme tepkimeleri H+ iyonları tarafından katalizlenir. Sülfürik asit bu tepkimede sıkça kullanılan bir katalizördür. Ester ismi Almanca Essig-Äther 'den gelir, bu, asetik asit etil esterin (etil asetatın) eski bir ismidir.
Esterlerin adlandırılması

Etil asetatın yapısı
Esterler bir alkolle bir karboksilik arasında bir denge tepkimesinde oluşurlar. Esterin adlandırılmasında onu oluşturan alkolden gelen alkil grubu ve ardından karboksilik asitten gelen alkanoat grubu kullanılır.[1] Örneğin, metanol ve butirik arasındaki tepkimeden metil butirat adlı ester, C3H7-COO-CH3, ve su meydana gelir. En basit ester H-COO-CH3'dür (metil format veya metil metanoat olrarak adlandırılır).
En basit karboksilik asitlerden meydana gelen esterler için IUPAC geleneksel isimleri önerir,[2] örneğin, format, asetat, propionat, butirat, ama bunlardan ancak asetatın daha başka ornatıkları olabilir. Daha uzun asitler için -oat ile biten alkan adları genelde tercih edilir, örneğin heksanoat. Aromatik asitlerin yaygın esterleri arasında benzoatlar (metil benzoat gibi) ve ftalatlar bulunur ve isimde ornatıklar için eklemelere izin verilir.
Fiziksel özellikler
Esterler hidrojen bağı oluşumlarında hidrojen bağı alıcısı olarak yer alırlar (kendilerini oluşturan alkollerin aksine).
Hidrojen bağlanmasına katılma yeteneği sayesinde aynı uzunluktaki hidrokarbonlardan daha çok suda çözünebilirler.
Ancak, oluşturabildikleri hidrojen bağlarının yetersiz kalan özellikleri yüzünden kendilerini oluşturan alkol ve asitlere
kıyasla daha hidrofobiktirler. Hidrojen bağı vericisi olmamaları nedeniyle birbirleriyle hidrojen bağı oluşturamazlar, bu yüzden de
esterler aynı molekül ağırlıklı karboksilik asitlere kıyasla daha uçucudurlar. Bu özellik onları analitik organik
kimyada çok yararlı kılar: uçuculuğu az olan ve bilinmeyen organik asitler çoğu zaman esterleştirilerek uçucu bir estere
dönüştürülebilirler, bu da gaz kromatografisi, gaz-sıvı kromatografisi veya kütle spektrometrisi ile analiz edilebilir.
Çoğu esterin kendine has bir kokusu vardır, bu da onların yapay koku ve parfümlerde kullanılmasına neden olmuştur. Örneğin:
| allil heksanoat |
ananas |
| benzil asetat |
armut, çilek, yasemin |
| bornyl asetat |
çam ağacı kokusu |
| butil butirat |
ananas |
| etil asetat |
tırnak oje temizleyicisi, maket boyası, uçak tutkalı |
| etil butirat |
muz, ananas, çilek |
| etil heksanoat |
çilek |
| etil sinamat |
tarçın |
| etil format |
limon, rom, çilek |
| etil heptanoat |
kayısı, kiraz, üzüm, raspberry |
| etil isovalerat |
elma |
| etil laktat |
üzüm |
| etill nonanoat |
üzüm |
| etil valerat |
elma |
| geranil asetat |
jeranyum |
| geranil butirat |
kiraz |
| geranil pentanoat |
elma |
| isobutil asetat |
kiraz, ahududu, çilek |
| isobutil format |
ahududu |
| isopentil asetat |
armut,muz |
| linalil asetat |
lavanta, adaçayı |
| linalil butirat |
şeftali |
| linalil format |
elma, şeftali |
| metil asetat |
nane |
| metil antranilat |
üzüm, yasemin |
| metil benzoat |
kananga |
| metil benzil asetat |
kiraz |
| metil butirat |
ananas, elma |
| metil sinnamat |
strawberry |
| metil pentanoat |
çiçeksi |
| metil fenil asetat |
bal |
| metil salisilat (keklik üzümü yağı) |
keklik üzümü |
| nonil kaprilat |
portakal |
| octil asetat |
portakal |
| oktil butirat |
alhavuç |
| pentil asetat (amil asetat) |
elma, muz |
| pentil butirat (amil butirat) |
kayısı, armut, ananas |
| pentil heksanoat (amil kaproat) |
elma, ananas |
| pentil pentanoat (amil valerat) |
elma |
| propil etanoat |
armut |
| propil isobutirat |
rom |
| terpenil butirat |
kiraz |
Ester sentezi
Esterler laboratuvarda birkaç farklı yoldan hazırlanabilir:
Ester tepkimeleri
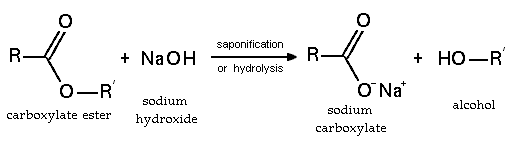
Ester sabunlaşması (baz hidrolizi)
Esterler çeşitli yollardan tepkirler: